インフルエンザワクチン予防接種を10月2日(月)より開始いたします。
お電話にて予約を受け付けております。

地域に根ざした家庭医として
お知らせ
令和5年9月7日(木)より毎週木曜日の診察時間を午前9時から12時までとさせて頂きます。
(午後の診察は休診となります)
皆様にはご迷惑、ご不便をおかけ致しますが宜しくお願い申し上げます。
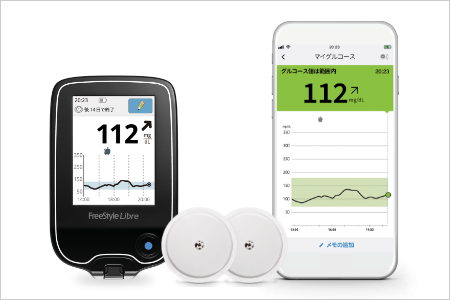
当院では、これまでの指先穿刺が必要であった血糖測定に加えて、センサーをかざすだけでグルコース値が測定できる「フリースタイルリブレ」を導入しております。
指先穿刺が不要になり、測定器をセンサーに近づけるだけで数値が表示されます。また、スマートフォンアプリの使用により、スマートフォンでの測定もできます。
指先穿刺が不要になり、測定器をセンサーに近づけるだけで数値が表示されます。また、スマートフォンアプリの使用により、スマートフォンでの測定もできます。
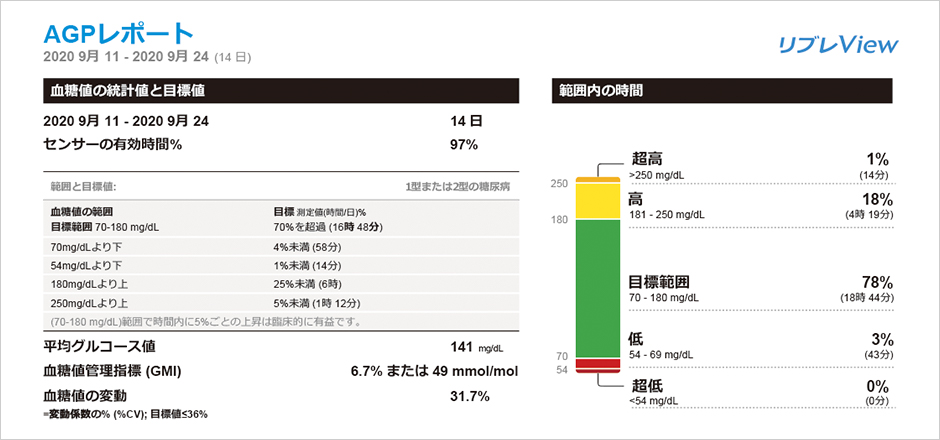
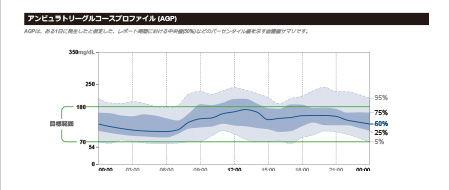
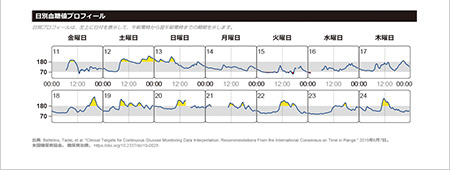
リブレは、間質液中のグルコース濃度を血糖値に換算して測定し1日を通して血糖値の変動をグラフでみることができ、夜間低血糖の発見にもつながります。
センサーは2週間つけっぱなしで、入浴やスポーツもできます。
2022年4月より、インスリン療法を行うすべての方が保険適用になります。
お気軽にご相談ください。
センサーは2週間つけっぱなしで、入浴やスポーツもできます。
2022年4月より、インスリン療法を行うすべての方が保険適用になります。
お気軽にご相談ください。
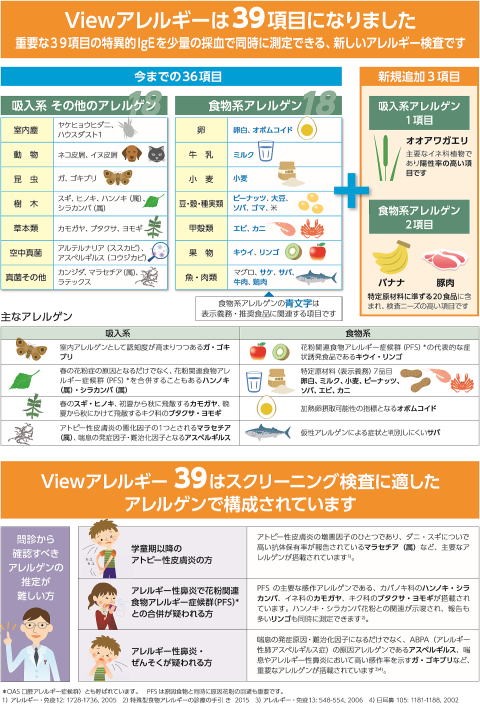
せき、鼻水、くしゃみ、目のかゆみ、じんましんなど悩まされているその症状は、実はアレルギーかもしれません。
花粉症や気管支喘息などのアレルギー性疾患は、体質や環境要因が複雑に絡み合って起こると考えられているため、何が原因で症状が起こるのかを知ることが大切です。
『View39』は少しの採血量で、一度に39項目のアレルゲン〈アレルギー反応を引き起こす物質〉を調べられる検査です。
検査費用は、医師の診断により症状が出ている方は健康保険が適用されます。診察料を含めて3割負担で6,000円弱になります。(その他検査、処方がある場合は別途かかります。)
症状が出ているかたは、お気軽にご相談ください。
花粉症や気管支喘息などのアレルギー性疾患は、体質や環境要因が複雑に絡み合って起こると考えられているため、何が原因で症状が起こるのかを知ることが大切です。
『View39』は少しの採血量で、一度に39項目のアレルゲン〈アレルギー反応を引き起こす物質〉を調べられる検査です。
検査費用は、医師の診断により症状が出ている方は健康保険が適用されます。診察料を含めて3割負担で6,000円弱になります。(その他検査、処方がある場合は別途かかります。)
症状が出ているかたは、お気軽にご相談ください。
睡眠時無呼吸症候群(SAS)は、睡眠中に何度も呼吸が止まった状態を繰り返す病気です。
多くの場合イビキを伴いますが、「睡眠時間は十分なのに疲れが取れない」「昼間に眠気を感じることがある」といった場合はSASが疑われます。
無治療のまま放っておくと生活習慣病を招いたり、悪化させたりするおそれがあります。
当院ではSASを簡易的に判断するための検査ができます。
検査機器がご自宅に送付され、一晩、眠るときに装着します。
1週間程度で検査結果がでますので後日、当院で結果をお伝えします。
治療が必要な場合は専門病院へご紹介いたします。
*8月から日本糖尿病療養指導士認定機構認定 糖尿病療養指導士が勤務しています。糖尿病をはじめ生活習慣病は、継続した治療が大切になります。(注射手技や血糖測定手技を外来で習得していただく、インスリン外来導入も行っています。)
また患者様が過ごしやすい生活が送れるように、どんなことでもお気軽にご相談ください。
多くの場合イビキを伴いますが、「睡眠時間は十分なのに疲れが取れない」「昼間に眠気を感じることがある」といった場合はSASが疑われます。
無治療のまま放っておくと生活習慣病を招いたり、悪化させたりするおそれがあります。
当院ではSASを簡易的に判断するための検査ができます。
検査機器がご自宅に送付され、一晩、眠るときに装着します。
1週間程度で検査結果がでますので後日、当院で結果をお伝えします。
治療が必要な場合は専門病院へご紹介いたします。
*8月から日本糖尿病療養指導士認定機構認定 糖尿病療養指導士が勤務しています。糖尿病をはじめ生活習慣病は、継続した治療が大切になります。(注射手技や血糖測定手技を外来で習得していただく、インスリン外来導入も行っています。)
また患者様が過ごしやすい生活が送れるように、どんなことでもお気軽にご相談ください。

睡眠時無呼吸症候群(SAS)は、睡眠中に何度も呼吸が止まった状態を繰り返す病気です。
多くの場合イビキを伴いますが、「睡眠時間は十分なのに疲れが取れない」「昼間に眠気を感じることがある」といった場合はSASが疑われます。
無治療のまま放っておくと生活習慣病を招いたり、悪化させたりするおそれがあります。
当院ではSASを簡易的に判断するための検査ができます。
検査機器がご自宅に送付され、一晩、眠るときに装着します。
1週間程度で検査結果がでますので後日、当院で結果をお伝えします。
治療が必要な場合は専門病院へご紹介いたします。
多くの場合イビキを伴いますが、「睡眠時間は十分なのに疲れが取れない」「昼間に眠気を感じることがある」といった場合はSASが疑われます。
無治療のまま放っておくと生活習慣病を招いたり、悪化させたりするおそれがあります。
当院ではSASを簡易的に判断するための検査ができます。
検査機器がご自宅に送付され、一晩、眠るときに装着します。
1週間程度で検査結果がでますので後日、当院で結果をお伝えします。
治療が必要な場合は専門病院へご紹介いたします。

*8月から日本糖尿病療養指導士認定機構認定 糖尿病療養指導士が勤務しています。糖尿病をはじめ生活習慣病は、継続した治療が大切になります。(注射手技や血糖測定手技を外来で習得していただく、インスリン外来導入も行っています。)
また患者様が過ごしやすい生活が送れるように、どんなことでもお気軽にご相談ください。
コンテンツ
医師・スタッフ紹介
院長 冨田 忠宏
大阪大学第一内科糖尿病研究室、大阪警察病院、国立大阪病院、関西労災病院と糖尿病を中心に生活習慣病や一般的な内科の治療に携わってまいりました。
その経験を活かし、平成10年よりトミタクリニックを父より継承し、生活習慣病を中心に内科全般の医療を行ってまいりました。今後も微力ながら地域の皆様の健康に少しでも貢献できればと考えております。
医院案内
トミタクリニック
〒541-0047
大阪府大阪市中央区淡路町4-7-2
TEL.06-6203-7636
FAX.06-6203-7637
| 月 | 火 | 水 | 木 | 金 | 土 | 日 | 祝 | 09:00~13:00 | ◯ | ◯ | ◯ | △ | ◯ | × | × | × |
|---|---|---|---|---|---|---|---|---|
| 14:00~17:00 | ◯ | ◯ | ◯ | × | ◯ | × | × | × |
△ 09:00~12:00
休診日:木曜午後・土曜・日曜祝日
※採血があるため健康診断は16時30分までに受付してください


交通案内
| 最寄駅 |
|
|---|---|
| 駐車場 | 当院の左横、前にはコインパーキングがございますのでそちらにいれてください。 領収書を当院受付にお持ちいただければ、診療時間相応の金額(上限1,000円まで)をお支払いします。(次回診察の時でも可能) ※但し、保険診療の方のみとさせていただきます。 |